हेलो दोस्तों आज हम बात करेंगे कि आफबाऊ का नियम क्या है? कोश तथा उपकोश क्या होते है। इलेक्ट्रॉनिक विन्यास क्या होता है, परमाणु कक्षक किसे कहते है? ऐसे कई महत्वपूर्ण सवालो के उत्तर जानेंगे। तो चलिए बिना कीमती समय बर्बाद किये शुरू करते है।
कोश तथा उपकोश किसे कहते है? (What is Shell and Subshell in Hindi)
कोश तथा उपकोश (Shell and Subshell) –
किसी भी परमाणु में इलेक्ट्रान विभिन्न मुख्य ऊर्जा स्तरों में व्यवस्थित होते है जिन्हें कोश कहा जाता है। मुख्य ऊर्जा स्तरों को जिन उप ऊर्जा स्तरों में विभाजित किया जाता है। उसे उपकोश कहा जाता है
कोशो को चार उपकोशो में विभाजित किया गया है जिन्हें क्रमशः s उपकोश, p उपकोश, d उपकोश, तथा f उपकोश कहा जाता है। इन उपकोशो को ऑर्बिटलो में विभाजित किया गया है जिन्हें क्रमशः s ऑर्बिटल, p ऑर्बिटल, d ऑर्बिटल, तथा f ऑर्बिटल कहा जाता है।
S उपकोश में एक कक्षक होते है। p उपकोश में तीन कक्षक होते है। d उपकोश में 5 कक्षक, तथा f उपकोश में 7 कक्षक होते है।
किसी भी कक्षक में विपरीत चक्रण के अधिकतम इलेक्ट्रान रह सकते है।
S उपकोश में अधिकतम 2 इलेक्ट्रान होते है। जबकि p उपकोश में अधिकतम 6 इलेक्ट्रान d उपकोश में अधिकतम 10 इलेक्ट्रान रह सकते है तथा f उपकोश में अधिकतम 14 इलेक्ट्रान रह सकते है। इलेक्ट्रान परमाणु कक्षक में भरे जाते है।
आफबाऊ का नियम क्या है?(What is Aufbau Principle in Hindi)
आफबाऊ का नियम (Aufbau Principle in Hindi) –
इलेक्ट्रानो को ऊर्जा स्तर के बढ़ते हुए क्रम में व्यवस्थित करना ही आफबाऊ का नियम (Aufbau principle in hindi) कहलाता है। इस नियम के अनुसार तत्वों का इलेक्ट्रॉनिक विन्यास बनाया जाता है।
तत्वों का इलेक्ट्रॉनिक विन्यास बनाने का नियम ही आफबाऊ का नियम कहलाता है। आफबाऊ जर्मन भाषा का शब्द है जिसका अर्थ है रचना या निर्माण करना।
इस नियम के अनुसार इलेक्ट्रानो को ऊर्जा स्तर के बढ़ते हुए क्रम में व्यवस्थित करना ही आफबाऊ का नियम (Aufbau principle in hindi) कहलाता है।
आफबाऊ का नियम के अनुसार सर्वप्रथम इलेक्ट्रान 1s कक्षक में प्रवेश करता है। 1s कक्षक पूर्ण हो जाने के बाद 2s कक्षक में इलेक्ट्रान प्रवेश करते है। इसी प्रकार चित्रानुसार इलेक्ट्रान 2p कक्षक में प्रवेश करते है। इसी प्रकार इलेक्ट्रान क्रमशः भरते रहते है।

इलेक्ट्रान मेघ क्या है? (What is Electron Cloud in Hindi)
इलेक्ट्रान मेघ (Electron Cloud) –
H – हाइड्रोजन परमाणु का इलेक्ट्रान मेघ-
किसी भी परमाणु के नाभिक के चारो तरफ इलेक्ट्रान तीव्र गति से परिक्रमा करते है। जिसके फलस्वरूप इलेक्ट्रानो का बैद्दुत ऋणावेश का घना बादल बन जाता है। जिसे इलेक्ट्रान का मेघ कहा जाता है। इसी घने इलेक्ट्रान को परमाणु कक्षक के नाम से जाना जाता है।
Chemistry 11-12 PDF
परमाणु कक्षक किसे कहते है?
परमाणु नाभिक के चारो तरफ का वह स्थान जहाँ इलेक्ट्रान पाए जाने की सम्भावना अधिक होती है। उसे ही परमाणु कक्षक कहा जाता है।
इलेक्ट्रॉनिक विन्यास किसे कहते है?
इलेक्ट्रॉनिक विन्यास (Electronic Configuration) –
इलेक्ट्रॉनिक विन्यास अक्रिय कोड नियम के अनुसार किया जाता है।
| हीलियम | नियान | आर्गन | क्रिप्टान | जीनान | रेडान |
| 2He | 10Ne | 18Ar | 36Kr | 54Xe | 86Rn |
आफबाऊ के नियमानुसार उपकोशो में इलेक्ट्रानो का वितरण किया जाता है।
कोश
↑
4s
↙ ↘
कक्षा कक्षक
अक्रिय गैस के अनुसार इलेक्ट्रानिक विन्यास।
7 = [He], 2s2, 2p3
5 = [He], 2s2, 2p1
13 = [Ne], 3s2, 3p1
17 = [Ne], 3s2, 3p5
21 = [Ar], 4s2, 3d1
किसी भी परमाणु में अर्द्ध भरा विन्यास तथा पूर्ण भरे विन्यास में इलेक्ट्रानो की वितरण एक समान रूप से होता है। अर्द्ध भरा विन्यास तथा पूर्ण भरा विन्यास के इलेक्ट्रानो के मध्य आंतरिक प्रतिकर्षण बल का मान न्यूनतम होता है तथा यह एक स्थायी विन्यास है।
अर्द्ध भरा विन्यास तथा पूर्ण भरा विन्यास एक स्थायी व्यवस्था है। d – उपकोश अपना स्थायी विन्यास बनाने के लिए s – उपकोश से इलेक्ट्रान ले लेता है। चूकि s उपकोश तथा d उपकोश में ऊर्जा का अंतर बहुत कम होता है। जब इलेक्ट्रानो का भराव प्रारंभ किया जाता है। तो आंतरिक इलेक्ट्रॉनिक प्रतिकर्षण बल का मान बढ़ जाता है।
जिसे कम करने के लिए s – इलेक्ट्रान, d – इलेक्ट्रान में कूद कर चला जाता है। यही अपवाद का कारण है। इलेक्ट्रानो का यह स्थानान्तरण सममित विन्यास बनाने के लिए होता है।
जब कोई परमाणु धनायन बनाता है। तो इलेक्ट्रान अंतिम कोश से निकलता है न कि अंतिम उपकोश से निकलता है।
जब कोई परमाणु ऋणायन बनाता है। तो इलेक्ट्रानो की संख्या बढ़ती है वृद्धि हुए इस इलेक्ट्रान को उपकोश में भरा जाता है न कि कोश में भरा जाता है।
Example –
26Fe = [Ar], 4s2, 3d6
26Fe+2 = [Ar], 4s0, 3d6
26Fe+3 = [Ar], 4s0, 3d5
29Cu = [Ar], 4s2, 3d9 [Wrong]
29Cu = [Ar], 4s1, 3d10 [Correct]
17Cl = [Ne], 3s2, 3p5
17Cl- = [Ne], 3s2, 3p6
NEET या दूसरे बोर्ड Exams के लिए कम्पलीट नोट्स बुक –
NEET Teachers के द्वारा एकदम सरल भाषा में लिखी गई नोट्स बुक 3 in 1, यानि कि एक ही किताब में जीव विज्ञान, रसायन विज्ञान और भौतिक विज्ञान की कम्पलीट कोर्स। यदि आपको इसकी जरूरत है तो नीचे दिए गये बुक इमेज पर क्लिक कीजिये और इसके बारे में और भी जानिए।
कोशो में इलेक्ट्रानो का वितरण कैसे किया जाता है?
कोशो में इलेक्ट्रानो का वितरण (Distribution of Electron) –
कोशो में इलेक्ट्रानो का वितरण बोर – बरी के नियमानुसार किया जाता है। कोशो में इलेक्ट्रानो की अधिकतम संख्या 2n2 होती है।
11Na = 1s2, 2s2, 2p2, 3s1
11Na = 2, 8, 1
17Cl = 1s2, 2s2, 2p6, 3s2, 3p5
17Cl = 2, 8, 7
32Ge = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p2
32Ge = 2, 8, 18, 4
उपकोशो में इलेक्ट्रानो का वितरण कैसे किया जाता है?
उपकोशो में इलेक्ट्रानो का वितरण (Distribution of electron in subshell) –
उपकोशो में इलेक्ट्रानो का वितरण आफबाऊ के नियमानुसार किया जाता है। उपकोशो की ऊर्जा का मान (n+l) मान पर निर्भर करता है यदि (n+l) का मान एक समान है तो इलेक्ट्रान सबसे पहले उस उपकोश में प्रवेश करेगा जिसके लिए मुख्य क्वांटम संख्या का मान न्यूनतम होता है। उपकोशो का क्रम f, d, p, s होता है परन्तु मुख्य क्वांटम संख्या बढ़ते हुए क्रम में व्यवस्थित होता है।
(n+l) का मान
| 1s, | 2s, | 2p 3s, | 3p 4s, | 3d 4p 5s, | 4d 5p 6s, | 4f 5d 6p 7s, | 5f 6d 7p 8s |
| 1 | 2 | 3 3 | 4 4 | 5 5 5 | 6 6 6 | 7 7 7 7 | 8 8 8 8 |
यदि (n+l) = 5 तो कक्षको की संख्या क्या होगी?
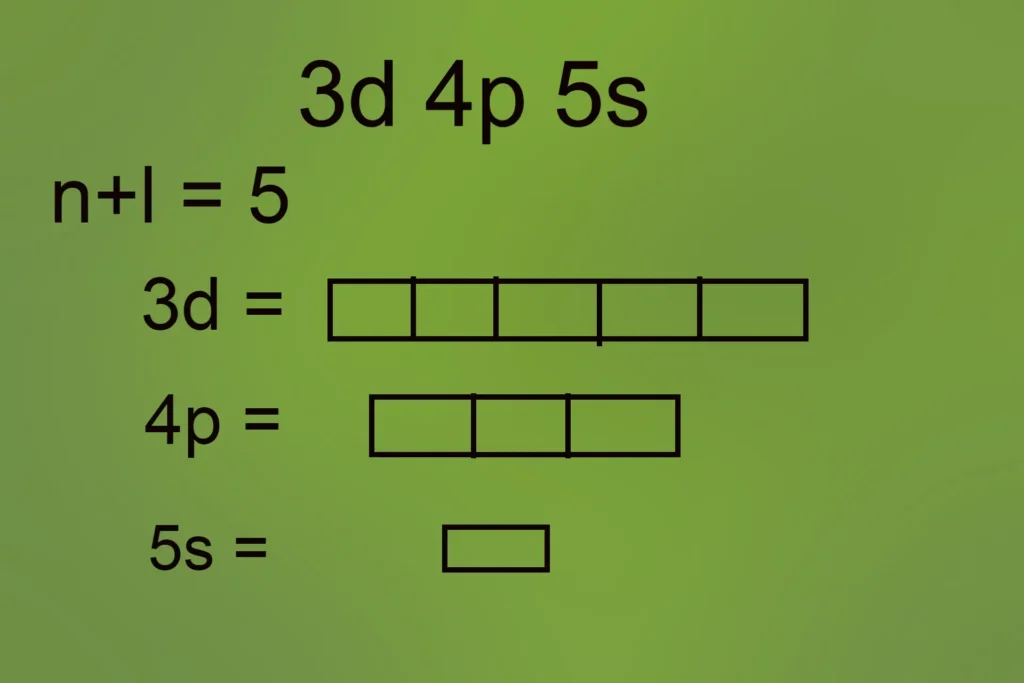
m = कुल कक्षको की संख्या
m = 5+3+1
m = 9 कक्षक
आवर्त सारणी में स्थान (Position in Periodic Table) –
किसी भी तत्व की आवर्त सारणी में स्थान निम्नलिखित नियमो के आधार पर ज्ञात कर सकते है।
नियम 1 – जब कसी तत्व का इलेक्ट्रॉनिक विन्यास बनाया जाता है तो अधिकतम मुख्य क्वांटम संख्या का मान उस तत्व के आवर्त को बतलाता है।
नियम 2 – जब किसी तत्व का इलेक्ट्रॉनिक विन्यास बनाया जाता है तो तत्व का विभेदी इलेक्ट्रान अथवा संयोजी इलेक्ट्रान अथवा अंतिम इलेक्ट्रान जिस उपकोश में प्रवेश करता है। वही उस तत्व का ब्लाक होता है।
नियम 3 – जब तत्व s ब्लाक तथा p ब्लाक से सम्बंधित होता है तो वह तत्व उपवर्ग A का होगा और यदि तत्व d तथा f ब्लाक से सम्बंधित होता है तो वह सदैव उपवर्ग B से सम्बंधित होगा।
नियम 4 – जब तत्व s ब्लाक तथा p ब्लाक से सम्बंधित होता है तो ऐसी स्थिति में अंतिम कक्षा में जो इलेक्ट्रानो की संख्या होती है। वही उस तत्व की वर्ग संख्या होगी।
नियम 5 – यदि कोई तत्व d – ब्लाक से सम्बंधित है तो ऐसी स्थिति में अंतिम दो कक्षा के इलेक्ट्रान का योग -8 के बराबर होता है यदि यह अंतर 3, 4, 5, 6, 7 आता है तो वर्ग संख्या वही होती है।
यदि अंतर 8, 9, 10 आता है तो वर्ग संख्या 8 होती है इसी प्रकार यदि यह अंतर 11, 12 आता है तो वर्ग संख्या 1 तथा 2 होगी।
नियम 6 – यदि तत्व f ब्लाक से सम्बंधित है तो ऐसी स्थिति में वर्ग संख्या सदैव Third- B होगा।
उदाहरण –
11Na = [Ne] , 3s1
आवर्त = Third
ब्लाक = s
वर्ग संख्या = First A
26Fe = [Ar] , 4s2, 3d6
आवर्त = Four
ब्लाक = d
वर्ग संख्या = 8
35 = [Ar] , 4s2, 3d10, 4p5
आवर्त = Four
ब्लाक = p
वर्ग संख्या = 8
80 = [Xe] , 6s2, 4f14, 5d10
आवर्त = Six
ब्लाक = d
वर्ग संख्या = 2+10+6+2-8 = 12
वर्ग संख्या = 2 – B
65 = [Xe] , 6s2, 4f9
आवर्त = six
ब्लाक = f
वर्ग संख्या = Third – B
अपवाद –
24 = [Ar] , 4s2, 3d4
= [Ar] , 4s1, 3d5
आवर्त = four
ब्लाक = d
वर्ग संख्या = 1+5+6+2-8 = 6
वर्ग संख्या = Six – B
Conclusion –
अब देख लेते है कि हम लोगो ने इसमें किन – किन चीजो के बारे पढ़ा।
कोश तथा उपकोश, आफबाऊ का नियम, इलेक्ट्रान मेघ, इलेक्ट्रॉनिक विन्यास, महत्वपूर्ण नोट, कोशो में इलेक्ट्रानो का वितरण, उपकोशो में इलेक्ट्रानो का वितरण, आवर्त सारणी में स्थान और नियम इन सभी चीजो के बारे में हम लोगो ने स्टेप बाई स्टेप जान लिया है।
दोस्तों आशा करता हूँ कि आपको आफबाऊ का नियम और इससे सम्बंधित दी गई जानकारी पसंद आई होगी। दोस्तों अगर यह जानकारी पसंद आयी है तो प्लीज इसे अधिक से अधिक अपने दोस्तों के साथ शेयर कीजिये। जिससे उन्हें भी इसका लाभ मिल सके मुझे पूरा विश्वास है कि आप इसे जरूर शेयर करेंगे।
धन्यवाद
इन्हें भी पढ़े –
DNA किसे कहते है? पूरी जानकारी
RNA किसे कहते है? पूरी जानकारी
कॉकरोच क्या होता है पूरी जानकारी एकदम सरल भाषा में
वायरस किसे कहते है? एकदम सरल भाषा में कम्पलीट जानकारी