दोस्तों आमतौर पर हम दैनिक जीवन में जिस तरह 12 वस्तुओ के लिए एक दर्जन, 144 वस्तुओ के लिए ग्रोस और 500 वस्तुओ के लिए रिंग का प्रयोग करते है उसी तरह अत्यधिक सूक्ष्म कणों के लिए मोल का शब्द का प्रयोग किया जाता है। दोस्तों परमाणु और अणु अत्यधिक सूक्ष्म कण होते हैं तथा पदार्थ की न्यूनतम मात्रा में भी इनकी संख्या बहुत अधिक होती है। इस अधिक संख्या को व्यक्त करने के लिए मोल मात्रक का उपयोग किया जाता है। यह पद लैटिन शब्द मोल से लिया गया है जिसका अर्थ ढेर या संचय होता है इसका प्रयोग सर्वप्रथम विल्हेम ओस्टवाल्ड के द्वारा 1894 में किया गया था।
मोल संकल्पना क्या है? (What is mole concept in Hindi?)
परमाणु और अणु का आकार बहुत ही सूक्ष्म होता है किसी पदार्थ की बहुत कम मात्रा में इनकी संख्या काफी अधिक होती है। इस संख्या को व्यक्त करने के लिए एक मात्रक की जरूरत होती है। जैसे द्रव्यमान का मात्रक ग्राम और लंबाई का मात्रक मीटर होता है उसी प्रकार पदार्थ की मात्रा के लिए मोल मात्रक प्रयोग किया जाता है।
किसी पदार्थ की वह मात्रा जिसमें उतने ही कण उपस्थित होते हैं जितने कार्बन 12 समस्थानिक के ठीक 12 ग्राम में उपस्थित परमाणुओ की संख्या होती है।
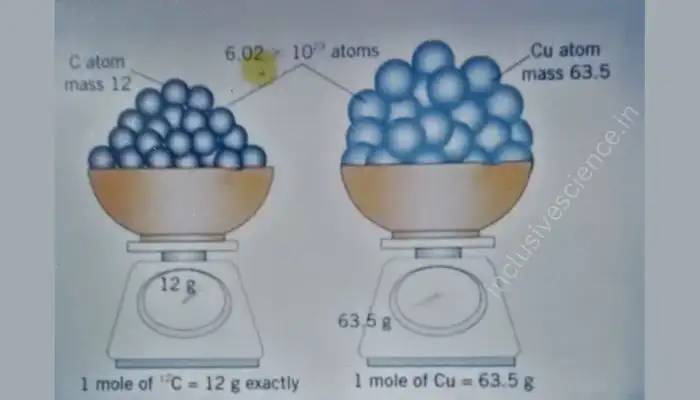
किसी पदार्थ की वह मात्रा जिसमें 6.022 × 1023 मूल कण उपस्थित होते हैं उसे पदार्थ का एक मोल कहा जाता है एक मोल में कणों की संख्या को आवोगाद्रो संख्या कहते हैं जिसे NA से प्रदर्शित करते हैं।
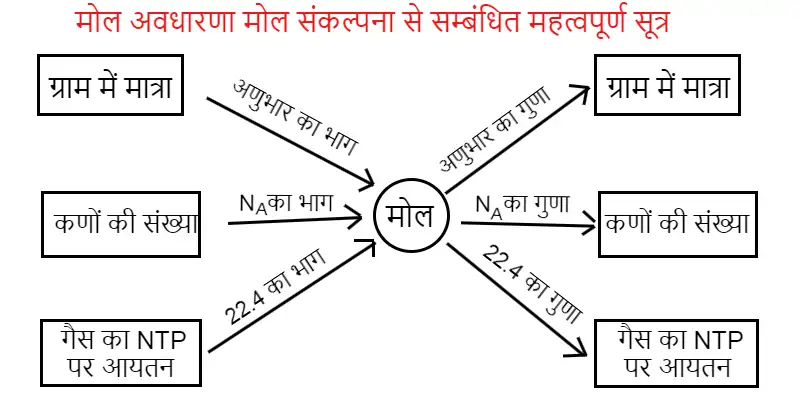
मोल अवधारणा मोल संकल्पना से संबंधित महत्वपूर्ण सूत्र
मोलर द्रव्यमान किसे कहते हैं? (What is molar mass in hindi?)
आसान शब्दों में कहे तो किसी पदार्थ के एक मोल के द्रव्यमान को उसका मोलर द्रव्यमान कहते हैं। इसे यह से प्रदर्शित किया जाता है मोलर द्रव्यमान को ग्राम/मोल में व्यक्त करते हैं ग्राम में व्यक्त मोलर द्रव्यमान संख्यात्मक रूप से परमाणु द्रव्यमान /आण्विक द्रव्यमान/ सूत्रद्रव्यमान के बराबर होता है।
जैसे जल का मोलर द्रव्यमान=18.02 ग्राम/मोल है।
NaCl का मोलर द्रव्यमान = 58.5 ग्राम/मोल है।
नोट – जिस प्रकार मोल संकल्पना में ग्राम परमाणु, ग्राम अणु, तथा ग्राम आयन आदि के स्थान पर केवल मोल का प्रयोग किया जाता है। उसी प्रकार परमाणु भार, अणुभार तथा सूत्र भार (सूत्र द्रव्यमान) आदि के स्थान पर मोलर द्रव्यमान प्रयुक्त किया जाता है।
Q. 80 ग्राम सोडियम हाइड्रोक्साइड (NaOH) की मोलो की संख्या कितनी होगी।
n = ?, w = 80 g
NaOH = 23+16+1= 40
n = w/m
n = 80/40
n = 2
प्रतिशत संघठन –
किसी यौगिक में उपस्थित तत्वों की प्रतिशत मात्रा को प्रतिशत संघठन कहते हैं।
सूत्र = यौगिक में उपस्थित तत्व द्रव्यमान/ यौगिक का मोलर द्रव्यमान
Example
H2O – H = 2
अणुभार= 18
2X100/18 = 100/9 = 11.11%
सूत्र , संरचना सूत्र, अणु सूत्र और मूलानुपाती सूत्र।
सूत्र किसे कहते हैं?
प्रतीकों का वह समूह जो किसी पदार्थ के एक अणु को दर्शाता है सूत्र कहलाता है।
जैसे जल का सूत्र H2O कैल्शियम कार्बोनेट का सूत्र CaCO3 सुक्रोज का सूत्र C12H22O11 है।
संरचना सूत्र –
किसी यौगिक (Compound) का वह रासायनिक सूत्र जो उसमें उपस्थित विभिन्न परमाणुओं की व्यवस्था को दर्शाता है संरचना सूत्र कहलाता है।
जैसे हाइड्रोजन पराक्साइड H2O2 का संरचना सूत्र –
H-O-O-H
अणु सूत्र किसे कहते हैं?
किसी यौगिक का वह सूत्र जो उसके एक अणु में उपस्थित विभिन्न परमाणुओं की वास्तविक संख्या को प्रदर्शित करता है अणु सूत्र कहलाता है।
जैसे हाइड्रोजन पराक्साइड का H2O2 है इसी प्रकार ग्लूकोज का C6H12O6 है।
मूलानुपाती सूत्र किसे कहते हैं?
किसी यौगिक का वह सरल सूत्र जो उस यौगिक के अणु में उपस्थित विभिन्न तत्वों के परमाणु की संख्या अर्थात परमाणुओं की सफलतम पूर्ण संख्या अनुपात को व्यक्त करता है उसे मूलानुपाती सूत्र (empirical formula) कहा जाता है।
- प्रतिशत संघठन से मूलानुपाती सूत्र ज्ञात करना – यौगिकों की रचना के आधार पर भी उसका मूल अनुपाती सूत्र ज्ञात किया जा सकता है इसके लिए निम्नलिखित पद प्रयुक्त होते हैं।
- पद 1- प्रत्येक तत्व की प्रतिशतता को उसके परमाणु भार द्वारा भाग दिया जाता है इससे प्रत्येक तत्व की मोल संख्या प्राप्त हो जाती है।
- पद 2- प्राप्त सभी संख्याओं को इनमें से सबसे छोटी संख्या द्वारा पुनः भाग दिया जाता है इसे मोल संख्या का सरल अनुपात प्राप्त होता है।
- पद 3 – तत्व के प्रतीको को पास पास लेकर उनकी सरल मोल संख्या को उनके नीचे दाहिनी ओर लिखने पर मूलानुपाती सूत्र प्राप्त हो जाता है अतः यौगिक का मूलानुपाती सूत्र ज्ञात करने के लिए हमें उसका भारात्मक संघठन तथा उसमें उपस्थित तत्वों के विषय में ज्ञात होना चाहिए।
अणु सूत्र कैसे निकाला जाता है?
- यौगिक के अणुसूत्र व मूलानुपाती सूत्र परस्पर निम्नलिखित प्रकार से संबंधित है।
- अणुसूत्र = (मूलानुपाती सूत्र) x n
- जहां n = अणुभार/ मूलानुपाती सूत्रभार
- मूलानुपाती सूत्रभार = मूलानुपाती सूत्र द्वारा प्रदर्शित सभी परमाणुओं के परमाणु भारों का योग
Question. एक अकार्बनिक यौगिक में 56.53 प्रतिशत पोटेशियम 8.69% कार्बन तथा 34.78% ऑक्सीजन है इसका मोलर द्रव्यमान 138 ग्राम है तो इसका मूलानुपाती सूत्र तथा आण्विक सूत्र ज्ञात कीजिए।
| तत्व | तत्व का प्रतिशत | परमाणु द्रव्यमान | आपेक्षिक संख्या = प्रतिशत परमाणु + द्रव्यमान | सरलतम परमाणु अनुपात |
|---|---|---|---|---|
| पोटेशियम (K) | 56.53 | 39 | 56.53+39 = 1.449 | 1.449/0.724 = 2.0 |
| कार्बन (C) | 8.69 | 12 | 8.69+12 = 0.724 | 0.724/0.724 = 1.0 |
| ऑक्सीजन (O) | 34.78 | 16 | 34.78+16 = 2.173 | 2.173/0.724 = 3.0 |
यौगिक में तत्वों का सरलतम अनुपात = 2 : 1 : 3
अतः यौगिक का मुलानुपाती सूत्र = K2CO3
मूलानुपाती सूत्र द्रव्यमान = 2(39) + 12 + 3(16) = 78 + 12 + 48 = 138 g
यौगिक का मोलर द्रव्यमान = 138 g
n = मोलर द्रव्यमान / मुलानुपाती सूत्र द्रव्यमान
n = 138/138 = 1
अतः यौगिक का आणविक सूत्र (अणुसूत्र) = K2CO3 x 1 = K2CO3
रससमीकरणमिति –
रस समीकरणमिति या तत्वानुपातिकी की रासायनिकी का वह क्षेत्र है जिसके अंतर्गत रासायनिक अभिक्रियाओं में भाग लेने वाले अभिक्रमको तथा उत्पादों के द्रव्यमनों और आयतनों का परीकलन किया जाता है।
रासायनिक अभिक्रिया में सीमांत अभिकर्मक क्या होते हैं।
कई बार रासायनिक अभिक्रियाओं में अभिकारको की उतनी मात्रा उपस्थित नहीं रहती है जितनी मात्रा संतुलित अभिक्रिया के लिए आवश्यक है ऐसी स्थितियों में एक अभिकारक की मात्रा दूसरे अभिकारक की मात्रा से अधिक होती है अतः वे अभिकारक जो अभिक्रिया में प्रस्तुत हो जाते हैं तथा उत्पाद की मात्रा को सीमित करते हैं सीमांत अभिकर्मक कहलाते हैं।
Q. 1 ग्राम मैग्नीशियम को 0.5 ग्राम ऑक्सीजन में जलाने पर मैग्नीशियम ऑक्साइड प्राप्त होता है इस अभिक्रिया में सीमांत अभिकर्मक की निम्न प्रकार गणना की जा सकती है।
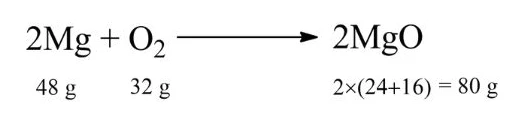
अतः 32 ग्राम ऑक्सीजन के साथ 48 ग्राम मैग्नीशियम अभिक्रिया करता है तो 1 ग्राम मैग्नीशियम अभिक्रिया करेगा = 32/48 = 0.67 g ऑक्सीजन के साथ परंतु वास्तव में ऑक्सीजन की 0.5 ग्राम मात्रा ही उपलब्ध है
अर्थात ऑक्सीजन के वास्तविक मात्रा, ऑक्सीजन की अभिक्रिया में उपलब्ध मात्रा से कम है अतः ऑक्सीजन अभिक्रिया में सीमांत अभिकर्मक है।
विलयनों में अभिक्रिया –
- द्रव्यमान प्रतिशतता (w\w%)
- मोल अंश
- मोलरता
- मोललता
द्रव्यमान – द्रव्यमान प्रतिशतता (w\w%) –
किसी विलेय के भार भागों की वह संख्या जो विलयन के 100 भार भागों में उपस्थित होती है उसे विलयन का द्रव्यमान प्रतिशत कहते हैं।
सूत्र –

जैसे – 5gm NaCl, 500gm विलायक में घुला है प्रतिशत बताइए
5×100/500 = 1%
मोल अंश –
विलयन में किसी घटक के मोलों की संख्या तथा विलयन में उपस्थित कुल मोलो की संख्या के अनुपात को उस घटक के मोल अंश कहते हैं।
माना एक विलयन में दो घटक A तथा B उपस्थित है इसके मोलो की संख्या क्रमशः na व nb है तथा मोल अंश क्रमशः xa व xb है।
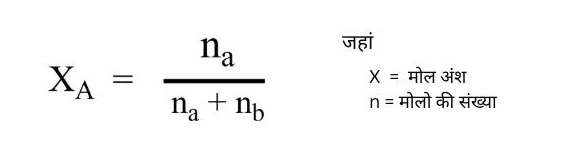
मोलरता –
1 लीटर विलयन में उपस्थित विलेय के मालों की संख्या उस विलयन की मोलरता कहलाती है।
सूत्र –

यदि मिलीलीटर (ml) मे हो तो गुड़े 1000 कर देना है।
मोलरता का मात्रक मोल/ लीटर (mol/L) होता है।
Q. 2 लीटर विलयन में 5 ग्राम सोडियम क्लोराइड युक्त विलयन की मोलरता की गणना कीजिए जबकि सोडियम क्लोराइड का आणविक भार 58.5 ग्राम/मोल हो।

मोललता (Molality) किसे कहते हैं?
1 किग्रा विलायक में किसी विलेय की मोलों की संख्या को मोललता कहते हैं इसे ‘m‘ व्यक्त करते हैं।
सूत्र –

Q. 6 ग्राम यूरिया (NH2-CO-NH2) 500 ग्राम जल में खुला हुआ है तो मोलरता ज्ञात कीजिए

मोलर द्रव्यमान किसे कहते है? Molar Dravyman Kise Kahte Hai?
मोलर द्रव्यमान (Molar Mass) –
किसी भी पदार्थ के 1 मोल का जो द्रव्यमान होता है। उसका मोलर द्रव्यमान कहलाता है जिसे “M” से निरूपित करते है, जिसका मात्रक gm/mole होता है।
Gram में व्यक्त Molar द्रव्यमान संख्यात्मक रूप से आण्विक द्रव्यमान अथवा सूत्र के द्रव्यमान के बराबर होता है। जैसे –
M CO2 = CO2 का आण्विक द्रव्यमान
M CO2 = CO2 का सूत्र का द्रव्यमान
M CO2 = CO2 का मोलर द्रव्यमान
M CO2 = CO2
= 12+32 = 44 ग्राम/मोल
ग्राम परमाणु द्रव्यमान किसे कहते है? Gram Parmanu Dravyman Kise Kahte Hai?
ग्राम परमाणु द्रव्यमान (Gram Atomic Mass) –
ग्राम परमाणु द्रव्यमान अथवा 1 ग्राम परमाणु किसी तत्व के 6.022×1023 परमाणुओं का द्रव्यमान होता है जिसे ग्राम में व्यक्त किया जाता है।
उदाहरण – सोडियम (Na) का ग्राम परमाणु द्रव्यमान या सोडियम के 1 ग्राम परमाणु (अर्थात 23 ग्राम Na), सोडियम के 1 मोल परमाणुओं का द्रव्यमान है।
सामान्य रूप से इसे हम निम्नाकित प्रकार व्यक्त कर सकते है।
ग्राम परमाणु द्रव्यमान = एक ग्राम परमाणु = 1 मोल परमाणु = 6.022×1023 परमाणु
ग्राम आण्विक द्रव्यमान किसे कहते है?
ग्राम आण्विक द्रव्यमान (Gram Molecular Mass) –
ग्राम आण्विक द्रव्यमान अथवा 1 ग्राम मोल, पदार्थ ( तत्व अथवा यौगिक ) के 6.022×1023 अणुओं का द्रव्यमान होता है जिसे ग्राम में व्यक्त किया जाता है।
उदाहरण – CaCO3 का ग्राम आण्विक द्रव्यमान या CaCO3 का एक ग्राम मोल (या 100 ग्राम), CaCO3 के 6.022×1023 अणुओं का ग्राम में द्रव्यमान में है।
सामान्य रूप से हम इसे निम्न प्रकार प्रदर्शित कर सकते है।
ग्राम आण्विक द्रव्यमान = एक ग्राम मोल = 1 मोल अणु = 6.022×1023 अणु
नार्मलता (Narmality) –
किसी पदार्थ की नार्मलता ग्राम तुल्यांको की वह संख्या है जो कि एक लीटर आयतन में उपस्थित है। उसे उस पदार्थ की नार्मलता कहा जाता है। जिसे N से निरूपित करते है।
ग्राम तुल्यांको की संख्या = e
VL विलयन रखता है = e
1L विलयन रखता है = e/v
N = e/v
e = w/E
E = पदार्थ का तुल्यांकी भार, जहाँ w = ग्राम में भार
N = w/E. V[L]
w = N.E V[ml] /1000 नार्मल = तुल्यांक/लीटर
नार्मलता तथा मोलरता में सम्बन्ध (Relation between Narmality and Molarity) –
माना w ग्राम विलेय पदार्थ की मात्रा एक मिलीलीटर विलयन में उपस्थित है।
W = E N V (c.c) / 1000
= m Mr. V (c.c) / 1000
चूँकि विलेय पदार्थ की मात्रा समान है। अतः
E N V (cc) / 1000= m Mr V (cc) / 1000
N/Mr = m/E = x
x = अम्लता, क्षारकता, भस्मता, संयोजकता, ऑक्सीकरण संख्या में परिवर्तन, धनायनो की संख्या, ऋणायनो की संख्या।
m/E = x
E = m/x
तुल्यांकी भार = अणुभार/अम्लता
उदाहरण –
- HCl = हाइड्रोक्लोरिक अम्ल
EHCl = MHCl/x
EHCl = 1+35.5/1
EHCl = 36.5 Ans
- H2SO4 = सल्फ्यूरिक अम्ल
EH2SO4 = MH2SO4/x
= 2+32+64/2
= 98/2
= 49 Ans
स्टाईकियोमीट्रिक गुणांक (Stoichiometric Coefficient) –
किसी भी संतुलित रासायनिक समीकरण में अभिकारक तथा उत्पादों के सूत्रों का गुणांक स्टाईकियोमीट्रिक गुणांक कहलाता है। जैसे –
2KClO3 ————- 2KCl + 3O2
पोटैशियम क्लोरेट का स्टाईकियोमीट्रिक गुणांक 2 है तथा ऑक्सीजन का स्टाईकियोमीट्रिक गुणांक 3 है।
अंश प्रतिमिलियन [Parts Per Million (PPM)] –
1 Million = 106
जब किसी विलयन में विलेय पदार्थ की मात्रा बहुत कम होती है। तो ऐसी स्थिति में विलयन की सांद्रता पीपीएम में नापी जाती है। किसी विलयन के मिलियन में विलेय पदार्थों के ग्रामो की संख्या PPM कहलाती है।
PPM = विलेय पदार्थ की मात्रा ×106/विलयन की मात्रा
जैसे – NaCl 10 PPM है तो इस कथन का अर्थ 106 ग्राम विलयन में 10 ग्राम सोडियम क्लोराइड घुला है।
इन्हें भी पढ़े –
- वर्गिकी, वर्गीकरण, नामकरण किसे कहते है? पूरी जानकारी एकदम सरल भाषा में।
- कशेरुकी और अकशेरुकी में क्या अंतर है? पूरी जानकारी ।
- कोशिका किसे कहते है | खोज, प्रकार, संरचना, कार्य पूरी जानकारी।
- जीवाश्म किसे कहते है | परिभाषा, प्रकार, कम्पलीट इनफार्मेशन जरूर पढ़े।
- लैंगिक प्रजनन क्या होता है, पूरी जानकारी
दोस्तों आशा करता हूँ कि आपको मोल किसे कहते है?(What is mole in Hindi) के बारे में दी गई जानकारी पसंद आई होगी। अगर आपको पसंद आई है, तो इसे ज्यादा से ज्यादा अपने दोस्तों की साथ शेयर करे जिससे उन्हें भी इसका लाभ मिल सके।
धन्यवाद
इन्हें भी पढ़े –
संकरण किसे कहते है? What is Hybridization in Hindi?